
WODA I ROZTWORY WODNE 

|
WODA I ROZTWORY WODNE |
WODA to tlenek wodoru (monotlenek diwodoru) o wzorze H2O. Wg obecnej nomenklatury IUPAC woda nosi nazwę oksydan.
Jest to najbardziej rozpowszechniony związek chemiczny w przyrodzie.
Wody powierzchniowe pokrywają ok. 73% powierzchni kuli ziemskiej. Są to słone wody mórz i oceanów oraz słodkie wody w lodowcach, wodach podziemnych, rzekach, jeziorach. W atmosferze woda występuje w postaci pary wodnej.
Woda może występować w trzech stanach skupienia i może go zmieniać w zależności od ciśnienia i temperatury:
gazowej - para wodna
ciekłej
stałej - lód.
Ze względu na właściwości fizyczne i możliwość zmian stanu skupienia, nieustannie krąży w przyrodzie tworząc obieg zamknięty.
OBIEG WODY W PRZYRODZIE
parowanie wody (głównie z mórz, oceanów i gleby)
skraplanie wody i opadanie na ziemię w postaci opadów (deszczu, śniegu, gradu)
spływanie wody opadowej do zbiorników wodnych
wsiąkanie wody opadowej w glebę i krążenie w postaci wód podziemnych
pobieranie wody gruntowej przez rośliny i odparowywanie jej nadmiaru.
WODA (w postaci czystej-destylowana) jest bez smaku, bezbarwną, bezwonną cieczą. Wody naturalne zawierają domieszki substancji, które mogą nadawać jej smak i zapach.
Wrze w temperaturze 100oC = 373K pod ciśnieniem 1013hPa.
Temperatura topnienia pod tym samym ciśnieniem wynosi 0°C = 273K.
Podczas zamarzania woda zwiększa swoją objętość (dlatego lód mający mniejszą gęstość, pływa po wodzie).
Gęstość wody zmienia się wraz ze zmianą temperatury - największą ma w temperaturze 4oC.
W cząstecze wody, atomy wodoru połączone są z atomem tlenu wiązaniem kowalencyjnym spolaryzowanym. Wspólne pary elektronów przesunięte są w kierunku atomu tlenu, a więc cząsteczka wody ma dwa bieguny: ujemny w pobliżu atomu tlenu i dodatni przy atomach wodoru.
Cząsteczka wody jest dipolem i ma budowę polarną. ![]()
Kąt między wiązaniami tlen-wodór wynosi ok.105 stopni. W postaci lodu kąt między tymi wiązaniami jest większy i wynosi ok.108 stopni.
Polarna budowa cząsteczki wody sprawia, że jest ona dobrym rozpuszczalnikiem dla wielu substancji o podobnej budowie cząsteczki.
![]()
PODSTAWOWE POJĘCIA DOTYCZĄCE ROZTWORÓW WODNYCH
ROZPUSZCZANIE - wnikanie cząsteczek jednej substancji między cząsteczki drugiej substancji (nie jest to reakcja chemiczna, ale zjawisko fizyczne).
ROZPUSZCZALNOŚĆ - liczba gramów danej substancji, która rozpuszcza się w 100g wody, dając roztwór nasycony w danej temperaturze.
ROZTWÓR - mieszanina jednorodna, składająca się z rozpuszczalnika i substancji rozpuszczonej, np. roztwór soli.
ROZTWÓR NASYCONY - taki roztwór, w którym nie można rozpuścić więcej substancji w danej temperaturze.
ROZTWÓR NIENASYCONY - taki roztwór, w którym można rozpuścić więcej substancji w danej temperaturze.
ROZTWÓR STĘŻONY - roztwór, w którym masa substancji rozpuszczonej jest znaczna (kilkadziesiąt procent) w stosunku do masy wody (rozpuszczalnika).
ROZTWÓR ROZCIEŃCZONY - roztwór, w którym masa substancji rozpuszczonej jest mała (kilka procent) w stosunku do masy rozpuszczalnika.
ROZTWÓR WŁAŚCIWY - roztwór, w którym cząsteczki ciała stałego mają rozmiary mniejsze od 10-9m.
KOLOID - mieszanina, w której cząsteczki ciała stałego mają rozmiary od 10-9m do 10-7m.
EMULSJA - mieszanina niejednorodna dwóch wzajemnie nie rozpuszczalnych cieczy, z których jedna jest rozproszona w drugiej w postaci małych kropelek, np. mleko.
ZAWIESINA - mieszanina cieczy i ciała stałego, której cząsteczki mają rozmiary większe od 10-7m.
STĘŻENIE ROZTWORU - określa ilość znajdującej się w nim substancji rozpuszczonej.
STĘŻENIE PROCENTOWE - liczba gramów sustancji rozpuszczonej w 100g roztworu. ![]()
![]()
ROZPUSZCZALNOŚĆ SUBSTANCJI
Szybkość rozpuszczania się danej substancji zależy od:
temperatury - im wyższa temperatura, tym większa energia cząsteczek i ilość zderzeń między nimi - szybkość rozpuszczania rośnie
mieszania - przyspiesza rozpuszczanie się substancji
rozdrobnienia substancji - ułatwia wnikanie cząsteczek wody między cząsteczki substancji - przyspiesza proces rozpuszczania.
Rozpuszczalność jest cechą charakterystyczną dla danej substancji.
Zależność między rozpuszczalnością a temperaturą przedstawia się graficznie za pomocą krzywej rozpuszczalności.
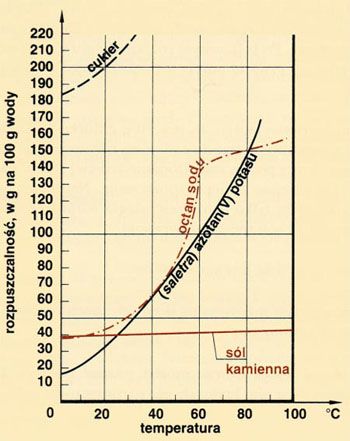
Rozpuszczalność większości ciał stałych w wodzie, zwiększa się wraz ze wzrostem temperatury.
Rozpuszczalność gazów wodzie zmniejsza się wraz ze wzrostem temperatury.
Woda ciepła zawiera mniej rozpuszczonych gazów niż woda zimna, dlatego ryby i rośliny łatwiej oddychają w wodzie zimnej, bo zawiera ona więcej tlenu.
PRZYKŁADOWE ZADANIE
Zadanie 1.
Ile gramów saletry potasowej (azotanu (V) potasu) należy rozpuścić w 300g wody w temperaturze 20oC, aby otrzymać roztwór nasycony?
Z wykresu rozpuszczalności odczytujemy, że rozpuszczalność saletry w 20oC wynosi 28g.
Układamy proporcję:
Jeśli w 100g wody rozpuści się 28g saletry potasowej,
to w 300g wody rozpuści się x g saletry potasowej.
Stąd x=84g
Odp. Należy rozpuścić 84g saletry potasowej w 300g wody, aby otrzymać roztwór nasycony w danej temperaturze.
![]()
STĘŻENIA ROZTWORÓW
STĘŻENIE ROZTWORU - określa ilość znajdującej się w nim substancji rozpuszczonej.
Stężenie roztworu można wyrazić w postaci:
a) stężenia procentowego
b) stężenia molowego
STĘŻENIE PROCENTOWE - liczba gramów sustancji rozpuszczonej w 100g roztworu. ![]()
Masę roztworu mroztw wyznacza się ze wzoru: mroztw= ms+ m rozp.
gdzie:
ms - masa substancji
mrozp. - masa rozpuszczalnika
Określenie - roztwór 20% oznacza, że w 100g roztworu znajduje się 20g substancji rozpuszczonej.
STĘŻENIE MOLOWE - liczba moli substancji rozpuszczonej n, w 1 dm3 roztworu. ![]()
Liczbę moli substancji rozpuszczonej n wyznacza się ze wzoru: n = ms/M
gdzie:
n - liczba moli
ms - masa substancji
M - masa molowa substancji rozpuszczonej - masa molowa, to masa 1 mola danej substancji, liczbowo równa masie cząsteczkowej związku chemicznego (wyrażonej w [u]); jednostką masy molowej jest [g/mol].
Określenie - roztwór 5 molowy oznacza, że 5 moli substancji rozpuszczono w 1 dm3 rozpuszczalnika
PRZYKŁADOWE ZADANIA Z ROZWIĄZANIAMI NA OBLICZENIA MOLOWE i STĘŻENIA ROZTWORÓW DOSTĘPNE W PLIKU ![]() doc.
doc.
![]()