
WIĄZANIA 

|
WIĄZANIA |
WIĄZANIE CHEMICZNE - są to charakterystyczne oddziaływania występujące pomiędzy atomami, grupami atomów, jonami lub cząsteczkami.
Wiązania chemiczne powstają w wyniku oddziaływania, przyjmowania lub uwspólniania elektronów
walencyjnych reagujących ze sobą atomów.
Każdy atom pierwiastka składa się z jądra atomowego oraz elektronów znajdujących się na tzw. powłokach elektronowych wokół jądra. Powłok tych jest kilka, a ich maksymalna ilość to siedem. W tworzeniu wiązania bierze udział głównie ostatnia powłoka tzw. walencyjna.
Teorię powstawania wiązań wprowadzili Kossel i Lewis.
Wegług niej, pierwiastki dążą do osiągnięcia oktetu (lit i beryl - dubletu) elektronów na powłoce walencyjnej - dążą do uzyskania struktury gazu szlachetnego.
Atomy gazów szlachetnych, różnią się od atomów pozostałych pierwiastków całkowicie zapełnionymi powłokami elektronowymi. Taka konfiguracja powoduje, że helowce są najbardziej biernymi chemicznie pierwiastkami.
Atomy tworząc wiązanie chemiczne mogą uzyskać stabilną konfigurację elektronową - podobną do konfiguracji gazów szlachetnych - (dubletową lub oktetową) na drodze:
przekazania elektronów jednego atomu drugiemu - powstaje wiązania heteropolarne - jonowe;
uwspólnienia (współużytkowania) elektronów walencyjnych - powstaje wiązanie kowalencyjne (atomowe) lub donorowo-akceptorowe (koordynacyjne).
Rodzaj wiązania między atomami, zależy od właściwości pierwiastków tworzących związek chemiczny. Można je scharakteryzować za pomocą elektroujemności, która jest umowną miarą "skłonności" atomu do przyciągania elektronów podczas tworzenia wiązania.
Pojęcie elektroujemności zostało wprowadzone przez L. Paulinga.
Elektroujemność to zdolność atomu do przyjmowania elektronów. Może być ona określana za pomocą liczb bezwymiarowych - skala elektroujemności Paulinga.
Do pierwiastków elektroujemnych zalicza się te, których atomy wykazują wyższą tendencję do przyłączania elektronów niż do jonizacji. Należą do nich niemetale (najbardziej elektroujemne są fluorowce).
Do pierwiastków elektrododatnich zalicza się te, których atomy wykazują wyższą tendencję do jonizacji (oddawania elektronów) niż do przyłączania elektronów. Należą do nich metale.
Wg sklali Paulinga:
elektroujemność pierwiastków należących do tej samej grupy maleje nieznacznie, ze wzrostem liczby atomowej.
elektroujemność pierwiastków należących do tego samego okresu rośnie ze wzrostem liczby atomowej.
![]()
RODZAJE WIĄZAŃ CHEMICZNYCH
WIĄZANIE JONOWE - polega na przejściu jednego lub kilku elektronów walencyjnych z atomów pierwiastka elektrododatniego do atomów pierwiastka elektroujemnego.
Atom pierwiastka oddający eletrony staje się kationem, a atom przyjmujący elektrony staje się anionem. Powstałe różoimienne jony przyciągają się siłami elektrostatycznymi, tworząc wiązanie - sieć jonową.
Wiązania jonowe są wiązaniami mocnymi.
Powstają pomiędzy pierwiastkami, w których różnica elektroujemności jest większa od 1,7 (wg skali Paulinga),
np.: chlorek sodu - Na Cl
Na - 1e --> Na+
Cl + 1e --> Cl -
Każdy jon sodu jest otoczony sześcioma jonami chlorkowymi, a każdy jon chlorkowy sześcioma jonami sodowymi.
Nie można rozróżnić, który kation sodu do którego anionu chlorkowego należy, podobnie jak nie da się określić, który anion chlorkowy należy do którego kationu sodu. Cały kryształ traktuje się więc jako jedną makrocząsteczkę.

|

|
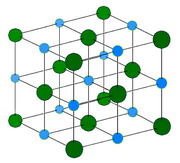
Sieć krystaliczna chlorku sodu |
Związki połączone wiązaniem jonowym charakteryzuje:
krystaliczna budowa
dobra rozpuszczalność w wodzie
wysoka temperatura topnienia
przewodnictwo elektryczne - zarówno w roztworze jak i w stanie stopionym przewodzą prąd elektryczny.
Wiązanie jonowe tworzy się w litowcach (wykluczając wodór) oraz berylowcach w związkach z tlenowcami
i fluorowcami.
![]()
WIĄZANIE KOWALENCYJNE (atomowe) - polega na utworzeniu wspólnej pary elektronów (wiązanie pojedyncze), dwóch wspólnych par elektronów (wiązanie podwójne) lub trzech wspólnych par elektronów (wiązanie potrójne), przez dwa atomy, z których każdy dostarcza do wytworzenia wspólnego dubletu (lub dubletów) taką samą liczbę niesparowanych elektronów.
Wiązania kowalencyjne występują pomiędzy pierwiastkami, w których różnica elektroujemności jest równa 0. Przykładami takiego wiązania są cząsteczki dwuatomowe: H2, O2, N2, Cl2, Br2, I2. np.:
|
|
![]()
WIĄZANIA KOWALENCYJNE SPOLARYZOWANE - polega na uwspólnieniu pary elektronów, ale wspólna para nie należy w jednakowym stopniu do obu atomów, lecz jest przesunięta w kierunku atomu bardziej elektroujemnego.
Zjawisko przesunięcia uwspólnionej pary elektronów w kierunku jednego z atomów, nosi nazwę polaryzacji wiązania. Ma to miejsce w przypadku, kiedy atomy pierwiastków różnią się elektroujemnością, ale różnica nie przekracza 1,7 w skali Paulinga.
Polarność wiązania rośnie w miarę jak zwiększa się różnica miedzy elektroujemnościami pierwiastków. Jeśli przekroczy wartość 1, 7 wiązanie przyjmuje charakter jonowy.
Wiązanie spolaryzowane jest najbardziej pospolite dla związków nieorganicznych i organicznych w skład których wchodzą atomy niemetali różniących się dość znacznie wartością elektroujemności.
Przykład wiązania kowalencyjnego spolaryzowanego:
połączenie chloru i wodoru w cząsteczce chlorowodoru.

![]()
WIĄZANIE KOORDYNACYJNE (semipolarne) - stanowi szczególny przypadek wiązanie typu kowalencyjnego. Polega na utworzeniu wspólnej pary elektronowej z elektronów dostarczonych przez jeden atom (tzw. donor). drugi atom (tzw. akceptor) uzupełnia własną powłokę walencyjną elektronami donora.
Warunkiem powstania wiazania koordynacyjnego jest zderzenie drobiny posiadającej wolną parę elektronową z drobiną dysponującą luką elektronową lub wolnym orbitalem w powłoce walencyjnej.
Przykład: wiązania w tlenku siarki (IV):

|

|

|
![]()
WIĄZANIE METALICZNE - powstanie wiązania metalicznego polega na przekształceniu atomów tego samego metalu lub atomów różnych metali w zbiór kationów i swobodnie poruszających się między nimi elektronów.
Wiązanie metaliczne może istnieć w stanie stałym lub ciekłym.
W stanie stałym węzły sieci krystalicznej metalu lub stopu są obsadzone przez kationy wykonujące wyłącznie ruchy oscylacyjne wokół węzła, natomiast zdelokalizowane elektrony poruszają się swobodnie w obrębie całego kryształu, podobnie jak drobiny substancji w stanie gazowym. Z tego względu mówi się o gazie elektronowym (chmurze elektronowej) wiązania metalicznego.
Kationy stanowiące rdzenie atomowe utrzymują się w swoich położeniach dzięki przyciądaniu elektrostatycznemu elektronów.
Właściwości metali wiążą się z istniejącym wiązaniem metalicznym:
dobre przewodnictwo cieplne i elektryczne można uzasadnić ruchliwością elektronów należących do dazu elektronowego;
połysk metaliczny wynika stąd, że pod wpływem światła widzialnego, elektrony znajdujące się na powierzchni kryształu wykonują drgania o częstotliwości promieniowania padającego. Promienie odbite mają taką samą częstotliwość jak promienie padające, co postrzegamy jako charakterystyczny połysk metalu;
plastyczność - ciągliwość, kowalność metali, tłumaczy się brakiem w krysztale kierunków uprzywilejowanych, a więc można przesuwać płaszczyzny sieciowe i powodować pęknięcia metali.
Model budowy wewnętrznej metalu:
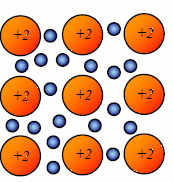
![]()
WIĄZANIE WODOROWE - jest to oddziaływanie (zwykle słabe) między kowalencyjnie związanym atomem wodoru i należącym do innej cząsteczki atomem silnie elektroujemnym, dysponującym wolną parą elektronową.
Atom wodoru (proton) może byś związany równocześnie z dwoma atomami, jeśli mają one małe wymiary i dużą elektroujemność. Wiązanie wodorowe występuje najczęściej w związkach wodoru z fluorem, chlorem, tlenem, azotem.
Wiązanie wodorowe występuje np.: między cząsteczkami wody.

Substancje, w których występuje wiązanie wodorowe charakteryzują się wysokimi temperaturami wrzenia
i topnienia.
![]()