
PRAWA CHEMICZNE

|
PRAWA CHEMICZNE |
PRAWO ZACHOWANIA MASY:
Łączna masa substratów równa jest łącznej masie produktów.
inaczej:
W każdej przemianie chemicznej masa substancji biorących udział w reakcji chemicznej nie ulega zmianie,
jest równa masie produktów powstałych w wyniku reakcji.
Prawo zachowania masy po raz pierwszy sformułował rosyjski chemik Michaił Łomonosow w roku 1748r.
Jego pierwotna treść brzmiała: "Wszystkie przemiany zachodzące w przyrodzie polegają na tym, że ile się odejmie od jednego ciała, tyle się dodaje do drugiego. W ten sposób, jeżeli gdzieś ubędzie nieco materii, to przybędzie w innym miejscu". (M. Łomonosow - "Rozważania o stałości i płynności ciał").
Niezależnie od M. Łomonosowa prawo zachowania masy odkrył francuski uczony Antoine Laurent Lavoisier (1789r.).
PRAWO STAŁOŚCI SKŁADU:
Pierwiastki tworzące związek chemiczny łączą się ze sobą w ściśle określonych stałych stosunkach wagowych.
Sposoby przedstawiania składu ilościowego związków chemicznych na przykładzie Al2O3
stosunek atomowy - wynika ze wzoru sumarycznego: liczba atomów glinu /liczba atomów tlenu = 2/3
stosunek masowy - na podstawie wzoru sumarycznego i mas atomowych obliczamy stosunek mas atomów w cząsteczce:

stosunek procentowy - stosunek masowy wyrażony w procentach:
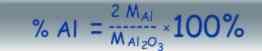
Prawo stałości składu podał w 1799 roku chemik francuski - Joseph Louis Proust: "Skład jednych i tych samych substancji niezależnie od sposobu ich otrzymania jest stały". Potwierdził je angielski uczony John Dalton w 1803r.
PRAWO STOSUNKÓW OBJĘTOŚCIOWYCH:
Objętość reagujących ze sobą gazów oraz gazowych produktów ich reakcji, odmierzone w tych samych warunkach temperatury i ciśnienia, pozostają do siebie w stosunkach niewielkich liczb całkowitych.
PRAWO OKRESOWOŚCI:
Właściwości fizyczne i chemiczne pierwiastów uporządkowanych zgodnie ze wzrastającą liczbą atomową powtarzają się okresowo.
W 1869 roku prawo okresowości podał rosyjski chemik Dmitrij Mendelejew.
"Właściwości chemiczne i fizyczne pierwiastków i ich związków, pozostają w okresowej ( periodycznej) zależności od ich mas atomowych".
Opracowując tabelę układu okresowego uszeregował wszystkie 63 znane wówczas pierwiastki, według ich ciężaru atomowego. Pozostawił puste miejsca w tablicy, twierdząc, że powinny one zostać zapełnione przez nieodkryte jeszcze pierwiastki. Na podstawie prawa okresowości Mendelejew przewidział istnienie i niektóre właściwości pierwiastków wówczas jeszcze nieznanych, między innymi galu, skandu, germanu, polonu, transu.
PRAWO AVOGADRO:
W tych samych warunkach fizycznych tzn. w takiej samej temperaturze i pod takim samym ciśnieniem, w równych objętościach różnych gazów, znajduje się taka sama liczba cząsteczek.
![]()