
KWASY KARBOKSYLOWE 

|
KWASY KARBOKSYLOWE |
![]()
Kwasy karboksylowe to związki organiczne, pochodne węglowodorów, w cząsteczce których znajduje się jedna lub więcej grup karboksylowych.
Grupa karboksylowa 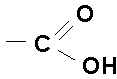 (- COOH), jest grupą funkcyjną.
(- COOH), jest grupą funkcyjną.
Wzór ogólny kwasów monokarboksylowych (posiadających jedną grupę karboksylową):
R - COOH gdzie R - grupa alkilowa |
Ar - COOH gdzie Ar - grupa arylowa |
Ogólny wzór kwasów karboksylowych nasyconych CnH2n+1 - COOH |
![]()
PODZIAŁ KWASÓW KARBOKSYLOWYCH
Kwasy karboksylowe można podzielić, w zależności od budowy reszty węglowodorowej na:
kwasy alifatyczne (nasycone i nienasycone),
cykloalifatyczne
aromatyczne.
W zależności od ilości grup karboksylowych kwasy dzielimy na:
monokarboksylowe, np.: kwas metanowy (mrówkowy) HCOOH
dikarboksylowe , np.: kwas etanodiowy (szczawiowy) HOOC-COOH,
trilokarboksylowe, itd.
![]()
NAZEWNICTWO
Nazwy systematyczne kwasów karboksylowych tworzy się od nazwy węglowodoru, który ma w cząsteczce tą samą liczbę atomów węgla dodając końcówkę -owy
Kwasy karboksylowe tworzą szereg homologiczny.
W nazewnictwie kwasów karboksylowych przyjmuje się nazwy zwyczajowe, wywodzące się najczęściej od nazwy miejsca ich występowania.
WZORY I NAZWY NIEKTÓRYCH KWASÓW:
Wzór kwasu |
Nazwa systematyczna |
Nazwa zwyczajowa |
HCOOH |
kwas metanowy |
kwas mrówkowy |
CH3COOH |
kwas etanowy |
kwas octowy |
C2H5COOH |
kwas propanowy |
kwas propionowy |
C3H7COOH |
kwas butanowy |
kwas masłowy |
C5H11COOH |
kwas pentanowy |
kwas walerianowy |
C15H31COOH |
kwas heksadekanowy |
kwas palmitynowy |
C17H35COOH |
kwas oktadekanowy |
kwas stearynowy |
C17H33COOH |
kwas cis-9-oktadecenowy |
kwas oleinowy |
|
kwas fenylokarboksylowy |
kwas benzoesowy |
![]()
WŁAŚCIWOŚCI KWASÓW KARBOKSYLOWYCH
Kwasy karboksylowe są mało lotne. Wraz ze wzrostem wielkości cząsteczki wzrastają temperatury topnienia i wrzenia kwasów karboksylowych. Wszystkie kwasy łatwo krystalizują.
Kwasy zawierające od 1 do 4 atomów węgla w czasteczce mieszają się z wodą w każdym stosunku,
a zawierające do 12 atomów węgla w czasteczce, rozpuszczają się dobrze w alkoholu.
Niższe kwasy karboksylowe są cieczami o ostrym zapachu, kwasy o średniej wielkości są oleistymi cieczami
o przykrej woni, a kwasy długołańcuchowe ciałami stałymi lub cieczami w zależności od stopnia nienasycenia.
Kwasy karboksylowe są aktywnymi chemicznie związkami, a ich właściwości chemiczne wynikają z obecności grupy karboksylowej.
Niższe kwasy karboksylowe ulegają reakcji dysocjacji, np.:
CH3COOH --> CH3COO - + H +
1 cząsteczka kwasu octowego dysocjuje na 1 anion octanowy i 1 kation wodorowy
Wyższe kwasy karboksylowe nie ulegają dysocjacji.
Aktywność chemiczna kwasów maleje ze wzrostem długości łańcucha węglowego.
Kwasy karboksylowe reagują z zasadami, tlenkami metali i metalami tworząc sole.
Reakcja z zasadami, np.:
CH3COOH + NaOH --> CH3COONa + H2O
W reakcji kwasu octowego z zasadą sodową powstaje octan sodu i woda
![]() Wyższe kwasy - tłuszczowe, w reakcji z zasadami, tworzą sole nazywane mydłami, np. mydło sodowe - stearynian sodu:
Wyższe kwasy - tłuszczowe, w reakcji z zasadami, tworzą sole nazywane mydłami, np. mydło sodowe - stearynian sodu:
C17H35COOH + NaOH --> C17H35COONa + H2O
![]() Reakcja z tlenkami metali, np.:
Reakcja z tlenkami metali, np.:
2 HCOOH + CuO --> (HCOO)2Cu + H2O
W reakcji kwasu mrówkowego z tlenkiem miedzi (II), powstaje mrówczan miedzi (II) i woda
![]() Reakcja z metalami, np.:
Reakcja z metalami, np.:
CH3COOH + Mg --> (CH3COO)2Mg + H2
W reakcji kwasu octowego z magnezem, powstaje octan magnezu i wodór
Grupę hydroksylową karboksylu można dość łatwo zastąpić chlorem, grupą aminową bądź resztą alkoholową otrzymując chlorki kwasowe, amidy i estry.
![]() W reakcji kwasu octowego z chlorkiem fosforu (V), otrzymujemy chlorek acetylu i kwas fosforowy (III):
CH3COOH + PCl5 --> CH3COCl + H3PO3
W reakcji kwasu octowego z chlorkiem fosforu (V), otrzymujemy chlorek acetylu i kwas fosforowy (III):
CH3COOH + PCl5 --> CH3COCl + H3PO3
![]() Działając amniakiem na chlorek acetylu (chlorek kwasu octowego), otrzymujemy amid kwasu octowego - acetamid:
Działając amniakiem na chlorek acetylu (chlorek kwasu octowego), otrzymujemy amid kwasu octowego - acetamid:
CH3COCl + NH3 --> CH3CONH2
![]() Działając alkoholem metylowym na kwas octowy, otrzymujemy ester - octan metylu:
Działając alkoholem metylowym na kwas octowy, otrzymujemy ester - octan metylu:
CH3COOH + CH3OH --> CH3COOCH3 + H2O
![]() Kwasy krboksylowe ulegają dehydratacji - odłączeniu czasteczki wody. W wyniku reakcji powstają bezwodniki kwasów, np.:
Kwasy krboksylowe ulegają dehydratacji - odłączeniu czasteczki wody. W wyniku reakcji powstają bezwodniki kwasów, np.:
w wyniku odłączenia cząsteczki wody od dwóch cząsteczek kwasu octowego, otrzymujemy bezwodnik kwasu octowego:
CH3COOH + HOOCH3C --> CH3COOCH3C + H2O
Szczególnie łatwo ulegają tej reakcji kwasy dikarboksylowe.
![]()
KWAS MRÓWKOWY HCOOH
Jest pierwszym członem szeregu homologicznego kwasów monokarboksylowych, nasyconych.
Jego nazwa wywodzi się stąd, że został wyodrębiony z jadu mrówek.
Występuje również w jadzie pszczół i w liściach pokrzyw.
Kwas mrówkowy jest bezbarwną cieczą o ostrym, duszącym zapachu i właściwościach parzących.
Jest trucizną.
Dobrze rozpuszcza się w wodzie.
Jest palny:
2HCOOH + O2 --> 2 CO2 + 2 H2O
Na skalę przemysłową kwas mrówkowy otrzymuje się w reakcji tlenku węgla (II) z ok. 30% wodnym roztworem wodorotlenku sodu.
Kwas mrówkowy stosuje się do garbowania skór, produkcji barwników, w przemyśle włókienniczym oraz jako substancję bakteriobójczą.
![]()
KWAS OCTOWY CH3COOH
Jest drugim kwasem w szergu homologicznym kwasów monokarboksylowych nasyconych.
Jest bezbarwną cieczą o intensywnym zapachu.
Bardzo dobrze rozpuszcza się w wodzie.
Pary kwasu octowego drażnią i niszczą błony śluzowe. Czysty kwas octowy jest nazywany "lodowatym".
Jest higroskopijny i odporny na działanie środków utleniających.
Spala się niebieskim płomieniem:
CH3COOH + 2 O2 --> 2 CO2 + 2 H2O
Powstaje w wyniku procesu fermentacji octowej - utlenienia alkoholu pod wpływem powietrza i bakterii (kwaśnienie napojów alkoholowych jak piwo, wino pozostawionych w otwartych naczyniach):
C2H5OH + O2 --> CH3COOH + H2O
Reaguje z metalami, tlenkami metali i zasadami dając sole - octany.
Kwas octowy jest stosowany w gospodarstwie domowym w roztworach 6% i 10%, jako przyprawa i składnik marynat.
W przemyśle stosowany jest do produkcji tworzyw sztucznych (np. jedwabiu sztucznego), barwników, substancji zapachowych, rozpuszczalników i leków.
![]()