
ATOM I CZĄSTECZKA 

|
ATOM I CZĄSTECZKA |
Atom (z greckiego atomos - niepodzielny)
najmniejszy, niepodzielny metodami chemicznymi składnik materii.
Atomy składają się z jądra i otaczających jądro elektronów.

W jądrze atomu znajdują się protony i neutrony. Elektrony stanowią chmurę elektronową wokół jądra.
NEUTRONY są cząstkami obojętnymi elektrycznie,
PROTONY mają ładunek elektryczny dodatni "+1",
ELEKTRONY mają ładunek elektryczny ujemny "-1".
Protony i neutrony noszą nazwę NUKLEONÓW.
Liczbę nukleonów w jądrze atomu danego pierwiastka nazywamy liczbą masową i oznaczamy symbolem A.
Liczba masowa A = liczba protonów + liczba neutronów.
LICZBA ATOMOWA (liczba porządkowa)- Z, wskazuje ilość protonów w jądrze atomu,np.
liczba atomowa wodoru Z=1 wskazuje, że wszystkie atomy wodoru zawierają w swoim jądrze po jednym protonie. Wszystkie atomy węgla mają po 6 protonów, więc liczba atomowa węgla Z=6.
Liczba atomowa Z = ładunek jądra = liczba protonów = liczba elektronów.
Protony i neutrony mają w przybliżeniu taką samą masę i są o ok. 2000 razy cięższe od elektronu.
Rozmiary atomów nie są dokładnie określone.
Zależą m.in. od rodzaju atomu i są rzędu dziesięciomiliardowej części metra.
Masa mieści się w przedziale 10-27 - 10-25kg.
W każdym atomie liczba protonów i elektronów jest jednakowa, dlatego atomy są obojętne elektrycznie.Elektrony są przyciągane siłami elektrostatycznymi przez protony znajdujące sie w jądrze.
Atomy różnych pierwiastków, różnią się rozmiarami, masą i budową wewnętrzną.
Pierwiastek chemiczny to zbiór takich samych atomów.
Cząsteczkę tworzą co najmniej dwa atomy połączone ze sobą: takiego samego pierwiastka - cząsteczka pierwiastka,
różnych pierwiastków - cząsteczka związku chemicznego.
ATOMOWA JEDNOSTKA MASY (unit - u) jest to 1/12 masy izptpou atomu węgla 12C.
MASA ATOMOWA - masa atomu wyrażona w atomowych jednostkach masy.
MASA CZĄSTECZKOWA - suma mas atomowych pierwiastów budujących związek chemiczny, wyrażona w atomowych jednostkach masy.
Atomy tego samego pierwiastka, różniące się liczbą neutronów w jądrze, nazywamy IZOTOPAMI.
Np. izotopy wodoru: prot - 1 proton i 1 neutron; deuter - 1 proton i 2 neutrony; tryt - 1 proton i 3 neutrony.
Izotopy mogą być:
![]() trwałe np. tlenu
trwałe np. tlenu
![]() promieniotwórcze (nietrwałe) - ulegają samorzutnym przemianom, którym towarzyszy emisja promieniowania i wytworzenie atomów innych pierwiastków.
promieniotwórcze (nietrwałe) - ulegają samorzutnym przemianom, którym towarzyszy emisja promieniowania i wytworzenie atomów innych pierwiastków.
Elektrony poruszają się wokół jądra w różnych odległościach, tworząc tzw. powłoki elektronowe.
Elektrony nie krążą wokół jądra atomowego w dowolny sposób, tylko są pogrupowane według energii jaką gromadzą.
POWŁOKA ELEKTRONOWA - jest to zbiór elektronów o zbliżonej wartości energii.
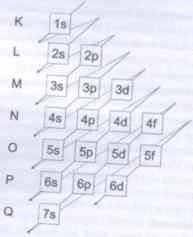
Nazwy powłok: K, L, M, N, O, P, Q
Ilość elektronów na każdej powłoce można obliczyć wg wzoru: 2n2, gdzie n - numer powłoki.
Ilość powłok elektronowych jest uzależniona od okresu, w którym znajduje się dany pierwiastek.
PIERWIASTEK MA TYLE POWŁOK, JAKI NUMER MA OKRES, W KTÓRYM SIĘ ZNAJDUJE
np. potas - leży w 4 okresie, ma 4 powłoki elektronowe.
| Numer okresu | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Numer powłoki | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Symbol powłoki | K | L | M | N | O | P | Q |
| Liczba elektronów na powłoce |
2 | 8 | 18 | 32 | 50 | 72 | 98 |
Aby rozpisać elektrony na poszczególne powłoki, należy wiedzieć:
![]() ile elektronów ma dany pierwiastek w atomie,
ile elektronów ma dany pierwiastek w atomie,
![]() ile powłok elektronowych posiada dany atom,
ile powłok elektronowych posiada dany atom,
![]() ile elektronów może się znaleźć w danej powłoce.
ile elektronów może się znaleźć w danej powłoce.
Przykład: rozmieszczenie elektronów na powłokach w atomie sodu:
11Na - K2 L8 M1
![]()
Uznaje się, że elektrony posiadają właściwości nie tylko korpuskularne, ale również falowe.
Elektron nie krąży po torach wokół jądra, ale porusza się w określonych przestrzeniach.
Miejsce najbardziej prawdopodobnego występowania elektronów wokół jądra nazywa się ORBITALEM.
Wielkości związane z energią i innymi stanami kwantowymi elektronu oznacza się liczbami, które nazywa się liczbami kwantowymi.
Do opisu stanu energetycznego elektronu w atomie wykorzystuje się 4 liczby kwantowe:
n - główna liczba kwantowa - określa stan energetyczny elektronów w atomie, wynikający z ich odległości od jądra. Główna liczba kwantowa przyjmuje wartości n = 1,2,3,4,5,6,7 i związana jest z nazwą odpowiedniego poziomu energetycznego atomu - powłoką elektronową (kolejnej głównej liczbie kwantowej, odpowiadają nazwy kolejnych powłok K, L, M, N, O, P, Q).
Elektrony z poziomu K mają n=1, z poziomu L n = 2, itd.
l - poboczna liczba kwantowa - określa kształt orbitalu.
Poboczna liczba kwantowa wyraża się liczbą całkowitą dodatnią, przy czym jej wartość maksymalna jest o jeden mniejsza od głównej liczby kwantowej, np. jeżeli n = 1 to l = 0; n =2 to l = 1, itd.
wartość pobocznej liczby kwantowej |
0 |
1 |
2 |
3 |
nazwa orbitalu (podpoziomu) |
s |
p |
d |
f |
m - magnetyczna liczba kwantowa - określa wzajemne położenie orbitali w przestrzeni. Wartość tej liczby, określa równocześnie liczbę orbitali w danym podpoziomie i obliczamy ją 2l + 1.
Wartość liczby jest zależna od pobocznej liczby kwantowej i przyjmuje wartości całkowite od -l do +l (łącznie z zerem), np.: jeżeli l = 2 to m = -2, -1, 0, 1, 2, istnieje więc 5 orbitali d.
s- spinowa liczba kwantowa charakteryzuje spin elektronu i może przybierać jedynie dwie wartości +1/2 i -1/2.
Pojemność orbitalu jest to maksymalna liczba elektronów, które mogą znajdować się na danym orbitalu, podpoziomie i poziomie atomu.
Budowę powłoki elektronowej atomu określa zasada Pauliego:
atom nie może zawierać dwóch elektronów, dla których wszystkie 4 liczby kwantowe miałyby tę samą wartość.
Oznacza to, że dwa elektrony muszą się różnić co najmniej wartością jednej liczby kwantowej.
Elektrony występujące na orbitalu określonym przez trzy liczby kwantowe: n, l, m, muszą różnić się liczbą spinową. Ponieważ kwantowa liczba spinowa może przyjmować tylko dwie wartości, więc każdy orbital może zawierać najwyżej dwa elektrony, które różnią się kierunkiem spinu elektronowego i tworzą parę elektronów sparowanych.
PODPOZIOM |
ILOŚĆ ORBITALI |
CAŁKOWITA LICZBA ELEKTRONÓW |
s (l=0) |
1 |
2 |
p (l=1) |
3 |
6 |
d (l=2) |
5 |
10 |
f (l=3) |
7 |
14 |
Z tabeli odczytujemy:
![]() podpoziom s mieści najwyżej 2 elektrony, ponieważ istnieje tylko jeden orbital s;
podpoziom s mieści najwyżej 2 elektrony, ponieważ istnieje tylko jeden orbital s;
![]() podpoziom p mieści najwyżej 6 elektronów, ponieważ istnieją trzy orbitale p, itd.
podpoziom p mieści najwyżej 6 elektronów, ponieważ istnieją trzy orbitale p, itd.
POZIOM |
TYP PODPOZIOMU |
CAŁKOWITA LICZBA ORBITALI |
CAŁKOWITA LICZBA ELEKTRONÓW |
K (n=1) |
s (l=0) |
1 |
2 |
L (n=2) |
s (l=0) |
4 |
8 |
M (n=3) |
s (l=0) |
9 |
18 |
N (n=4) |
s (l=0) |
19 |
32 |
Z tabeli odczytujemy:
![]() na wszystkich poziomach energetycznych atomu, istnieje zawsze jeden orbital s;
na wszystkich poziomach energetycznych atomu, istnieje zawsze jeden orbital s;
![]() orbitale d istnieją na wszystkich poziomach energetycznych atomu z wyjątkiem poziomów K i L;
orbitale d istnieją na wszystkich poziomach energetycznych atomu z wyjątkiem poziomów K i L;
![]() ilość elektronów na każdym poziomie, np.: poziom L mieści 8 elektronów, ponieważ posiada 4 orbitale (jeden s i trzy p).
ilość elektronów na każdym poziomie, np.: poziom L mieści 8 elektronów, ponieważ posiada 4 orbitale (jeden s i trzy p).
KSZTAŁTY ORBITALI
ORBITAL s
jest zawsze kulisto - symetryczny. |
|
ORBITAL p
Orbitale p mają kształt hantli. |
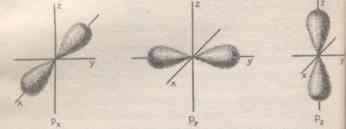
|
ORBITAL d |
|
SCHEMATYCZNE PRZEDSTAWIANIE ELEKTRONÓW I ORBITALI
|
Orbitale s, p, d, f oznacza się za pomocą klatek, w których rozmieszcza się elektrony zobrazowane przez skierowane do dołu i do góry strzałki (różne zwroty strzałek oznaczają znak spinu). |
ZAPIS SYMBOLICZNY : ns2, gdzie n - wartość głównej liczby kwantowej, s - typ orbitalu, 2 - liczba elektronów w danym orbitalu
PRZYKŁAD: wypełnienie elektronami orbitali w atomie węgla
Węgiel ma 6 elektronów (Z=6)
6 C:
1s2 2s2 2p2 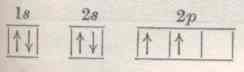
Tlen - 8 O: 1s2 2s2 2p4
![]()
Z HISTORII
W 1913 roku Niels Bohr opracował model budowy atomu wodoru, co dało podstawy do zrozumienia budowy atomów innych pierwiastków. Teoria Bohra uzupełniona i rozszerzona o matematyczne obliczenia, daje pełny obraz budowy atomu, zjawisk jakie obserwujemy podczas reakcji chemicznych i budowy cząsteczek.
Postulaty Bohra:
1. Elektrony mogą krążyć wokół jądra jedynie po ściśle określonych orbitach stacjonarnych.
2. Przejście elektronu z niższego poziomu energetycznego na poziom wyższy jest możliwe tylko wtedy, gdy atom pobierze porcję energii. Natomiast przejście ze stanu o energii wyższej do stanu o energii niższej wiąże się z oddaniem energii.
W dzisiejszych czasach wiadomo już, że nawet tak małe cząstki jak protony, neutrony a nawet elektrony da się jeszcze podzielić na mniejsze - kwarki.
Modele budowy atomu:
![]() niepodzielna kulka - uznawano, że atom jest niepodzielną, sztywną, bez struktury wewnętrznej kulką;
niepodzielna kulka - uznawano, że atom jest niepodzielną, sztywną, bez struktury wewnętrznej kulką;
![]() model rodzynkowy - przyjmowano, że atom jest kulką, w której są mniejsze kulki (elektrony), tak jak w cieście są rodzynki;
model rodzynkowy - przyjmowano, że atom jest kulką, w której są mniejsze kulki (elektrony), tak jak w cieście są rodzynki;
![]() model jądrowy - większość masy i całkowity ładunek dodatni skupiony jest w małej przestrzeni w centrum atomu zwanej jądrem, elektrony krążą wokół jądra;
model jądrowy - większość masy i całkowity ładunek dodatni skupiony jest w małej przestrzeni w centrum atomu zwanej jądrem, elektrony krążą wokół jądra;
![]() model planetarny (Bohra) - elektrony mogą poruszać się wokół jądra tylko po określonych orbitach, (teoria wyjaśnia jak poruszają się elektrony wokół jądra, ale nie podaje przyczyny);
model planetarny (Bohra) - elektrony mogą poruszać się wokół jądra tylko po określonych orbitach, (teoria wyjaśnia jak poruszają się elektrony wokół jądra, ale nie podaje przyczyny);
![]() model kwantowy (ruchu elektronów wokół jądra) - mechanika kwantowa wyjaśnia dlaczego elektrony przyjmują określone energie.
model kwantowy (ruchu elektronów wokół jądra) - mechanika kwantowa wyjaśnia dlaczego elektrony przyjmują określone energie.
![]()